Frank Michler
Protokoll zum Praktikum Neurobiologie/Verhalten WS 1998/99
Schwerpunktthema:
Entwicklung des Antennallobus von Manduca sexta.
vom 11.01.99 bis 22.01.99
Betreuer: Dr. Joachim Schachtner
Inhalt:
I. Einleitung
II. Methoden
III. Ergebnisse
IV. Diskussion
I. Einleitung:
Manduca sexta (Tabakschwärmer) aus der Familie der Sphingidae ist ein holometaboles
Insekt, das heißt, nach mehreren Larvenstadien findet eine Verpuppung statt.
Etwa 20 Tage nach der Verpuppung schlüpft das adulte Tier. Fig. 1 zeigt die
verschiedenen Stadien von Manduca sexta.
|

Fig. 1
(das Bild stammt aus: http://zebra.biol.sc.edu/moth/manduca-l.html)
|
Der Antennallobus (AL)
Im AL findet die erste Synaptische Verarbeitung der olfaktorischen Information statt.
Die Neurone des AL lassen sich in zwei Gruppen einteilen: lokale Interneurone (LN), die sowohl Ein- als auch
Ausgänge im AL haben, und Projektionsneurone, die Eingänge im AL und Ausgänge in anderen
Hirnregionen (z.B. Protocerebrum) haben. Die Somata der AL-Neurone liegen außerhalb des Neuropils
in zwei Zellgruppen: der lateralen Zellgruppe (Fig.2, lc) und der medianen Zellgruppe (Fig.2, mc).
Die Synapsen konzentrieren sich auf sogenannte Glomeruli. Manduca sexta hat etwa 64 solcher Glomeruli pro AL.
Männliche Tiere haben zusätzlich einen sog. Macroglomerularkomplex (MGC).
Dieser verarbeitet die Information von Sexualpheromonen.
|
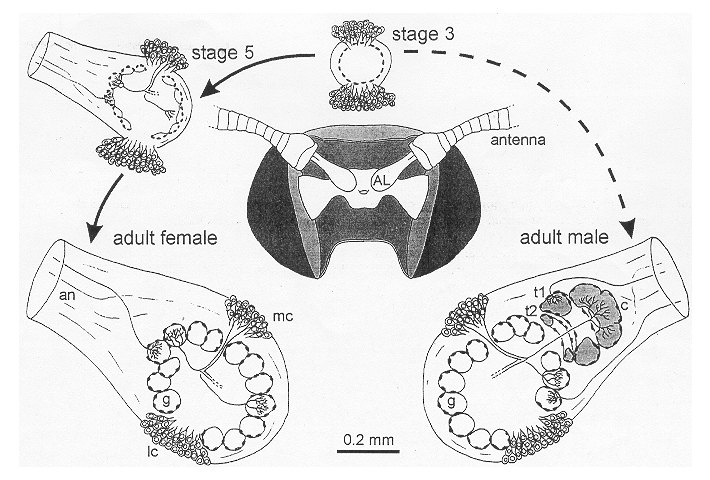
Fig. 2 |
Entwicklung des AL
Der AL entwickelt sich am Ort des rudimentären larvalen
antennalen Zentrums. Die Zellen des AL entstammen fünf Neuroblasten,
die sich während der Larvalzeit intensiv teilen. Die Zellteilungen
sind etwa ab dem zweiten/dritten Tag des Puppenstadiums abgeschlossen (Hildebrand,
Rössler, Tolbert in [2]).
Die Entwicklung des AL beginnt damit, daß die Dendriten der olfaktorischen
Rezeptorneurone (ORN) in die Sensillen der Antenne auswachsen. Danach wachsen
ihre Axone zum späteren AL. Dort durchstoßen sie die Wand aus
Gliazellen (Fig. 3, st.4), die das AL-Neuropil umgibt und wachsen in das
Neuropil ein. Ihre Enden wachsen in Gruppen aufeinander zu und formen sogenannte
Protoglomeruli (Fig. 3, st.5). Diese werden von den Gliazellen umwachsen
(Fig. 3, st.6), die dann eine Begrenzung für die Verzweigungsbäume
der daraufhin einwachsenden Neurite der AL-Neurone darstellen (Fig. 3,
st.7) (Hildebrand et. al. 1997 in [2]). Die Glomeruli bilden sich etwa
zwischen dem siebenten und dem zehnten Tag der Puppenentwicklung heraus.
Dieser Zeitraum deckt sich mit einem Titeranstieg des Entwicklungs-Hormons
20-Hydroxy-Ecdyson (siehe Fig. 4, Kurve 3: 20E), was einen kausalen Zusammenhang
vermuten läßt. |
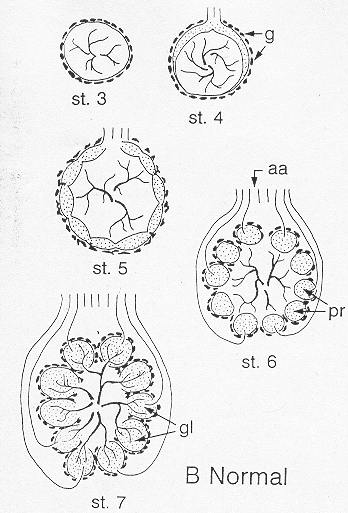
Fig. 3
|
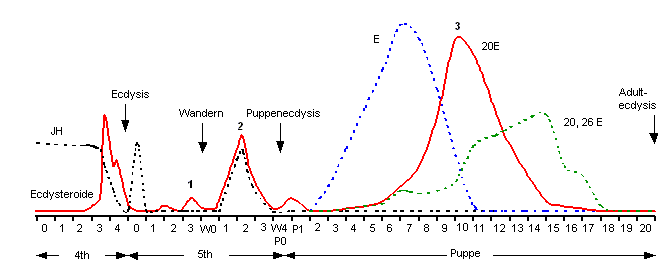
Fig. 4
II. Methoden
Das Verfahren zur Herstellung der Hirnschnitte stellt eine Abwandlung
der in [1], S. 7 dargestellten Methode "PAP-FÄRBUNG AN VIBRATOMSCHNITTEN"
dar. Aus Puppen der Stadien P7 bis P11 wurden die Gehirne herauspräpariert
und in Formalin (4% in Pbs) fixiert. Dann wurden sie in Gelatine eingebettet
und mit einem Vibratom geschnitten (Schnittdicke: 40 ?m). Die Schnitte
wurden 3 mal 10 min in SST (mit 0,1% TritonX) gespült. Zur Absättigung
unspezifischer Bindungsstellen wurden die Schnitte für eine Stunde
mit 5% Normal Goat Serum (NGS) inkubiert (Präinkubation). Anschließend
wurde wieder gespült (3x10min in SST, 0,1%TrX). Mit den meisten Schnitten
wurde eine DAB/Peroxidase-Färbung durchgeführt. Dazu wurden
sie etwa 20h mit einem Antikörper gegen Allatostatin (1:5000) inkubiert
(primärer Antikörper). Nach erneutem Spülen wurden sie 1h
mit dem sekundären Antikörper, an welchen schon das Peroxidase-Molekül
gebunden war, inkubiert. Nun wurde wieder gespült und die DAB-Reaktion
(DAB=3,3'-Diamino-Benzidin-tetrahydrochlorid; die Polymerisation des farblosen
Monomers zum braunen Polymer wird durch Peroxidase katalysiert) durchgeführt.
Mit zwei Gehirnen wurde eine Fluoreszenz-Doppelfärbung durchgeführt.
Statt der Peroxidase waren an den sekundären Antikörpern entsprechende
Fluoreszenzfarbstoffe gebunden (Anti-Allatostatin 1:4000? Diisothiofluoreszin
Anregung:490nm, Emission: 525nm; Anti-Synaptotagmin 1:2000 ? Texasrot Anregung:
596nm; Emission: 615nm; Werte aus[3]).
Die Präparate wurden Lichtmikrosopisch (Zeiss Axioscop) bzw. am
Konfokalen Laserscanmikroskop (Leika) untersucht.
Bei Hirnschnitten aus Puppensttadien von P3 bis P17 wurde die Zahl
der Gefärbten Zellen gezählt. Zellen, die auf mehreren Schnitten
zu sehen waren, wurden mehrmals gezählt.
III. Ergebnisse
 |
 |
 |
| Fig.5A: P7 |
Fig.5B: P8 |
Fig.5C: P9 |
 |
 |
 |
| Fig.5D: P10 |
Fig.5E: P10 |
Fig.5F: P11 |
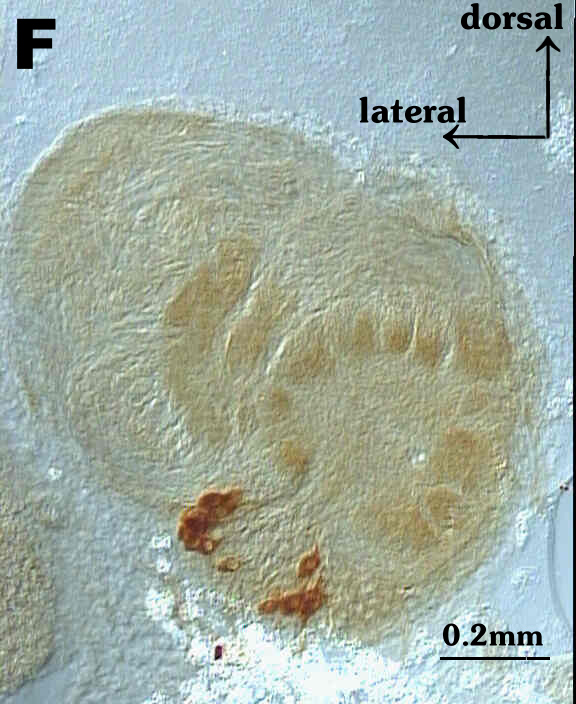
Fig.5A bis Fig. 5F zeigen Antennalloben in verschiedenen Puppenstadien.
Die Größenverhältnisse sind aus 5F ersichtlich. Die AL
sind so orientiert, daß die Antennennerven nach links oben austreten
(vgl. Fig.5F und Fig2). In A bis C sind die AL eher peripher (weiter außen)
geschnitten und erscheinen daher kleiner, während in D bis F die Schnittebenen
eher durch das Zentrum des AL gehen.
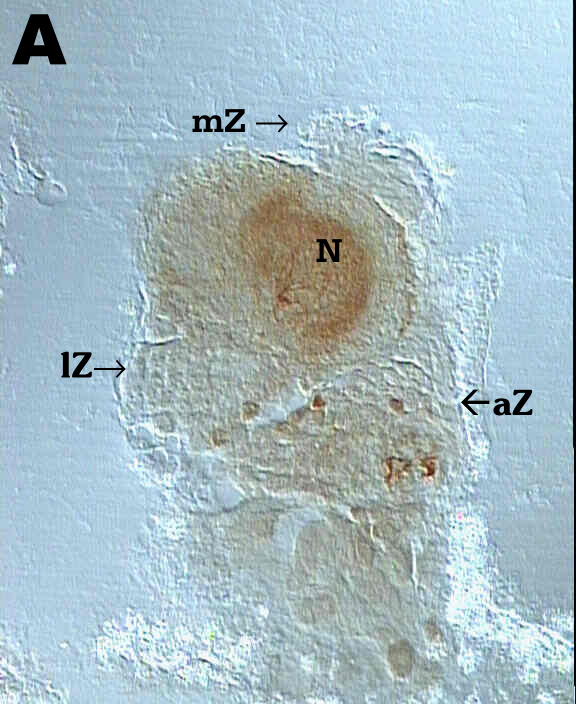
Fig. 5A zeigt einen weiblichen AL im Stadium P7. Das Neuropil (N) ist
deutlich gefärbt, es sind jedoch kaum Strukturen zu erkennen. Rechts
oben ist die mediane Zellgruppe (mZ) zu sehen; rechts unten sieht man noch
eine andere Zellgruppe (aZ). Diese gehört jedoch nicht mehr zum Antennallobus,
sondern zum Zentralhirn. Fig. 5B zeigt einen weiblichen AL im Stadium P8.
Auch hier erscheint das Neuropil noch strukturlos. In der lateralen Zellgruppe
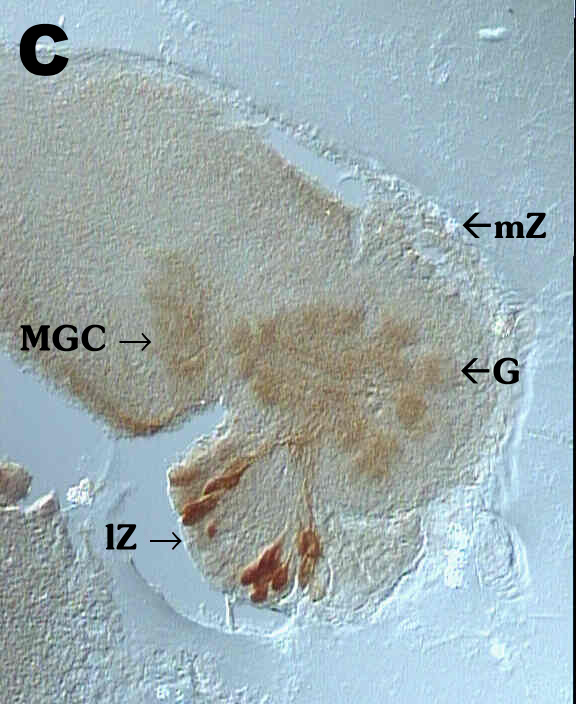
sind einige Zellkörper angefärbt. Fig. 5C zeigt einen männlichen
AL im Stadium P9. Der nur bei Männchen auftretende Macroglomerularkomplex
(MGC) ist deutlich zu sehen. Im Neuropil sind schon Glomeruli (G) zu erkennen.
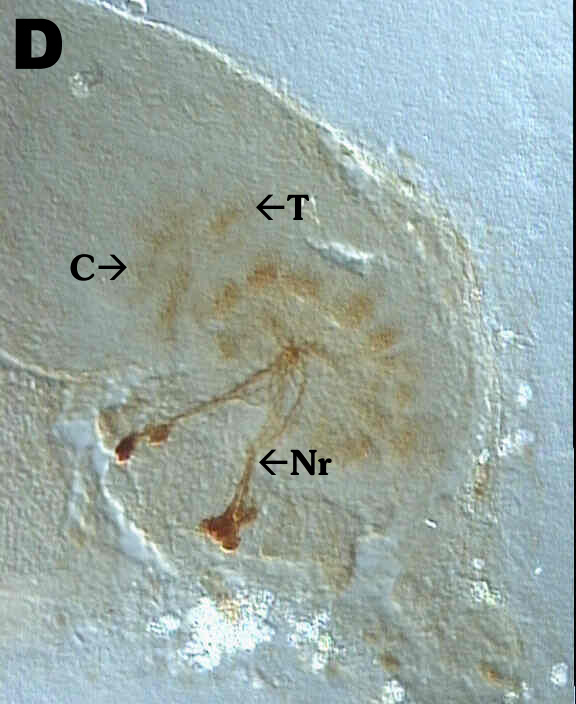
In Fig. 5D (männlich, P10) sieht man, wie die Neurite (Nr) zunächst
ins Zentrum des Neuropils ziehen, und dann erst in die Glomeruli verzweigen.
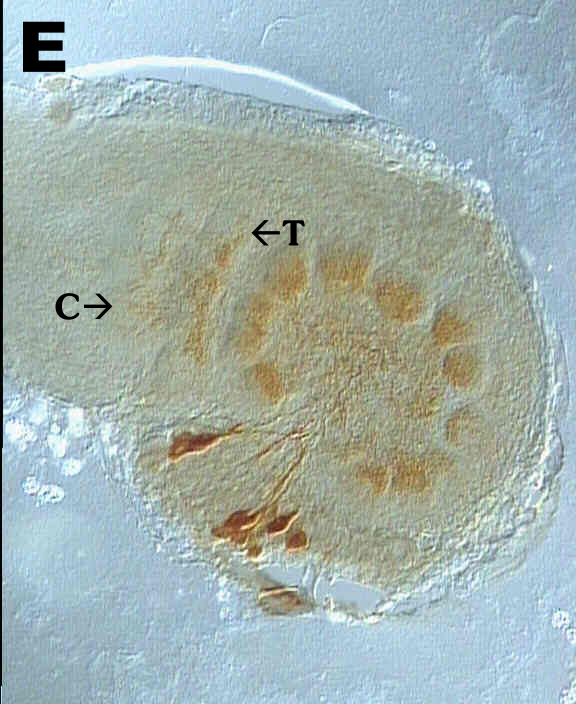
In Fig. 5E kann man Cummulus (C) und Toroid (T) - Teile des MGC - erkennen.
Die Glomeruli sind deutlich ausgeprägt, es ist jedoch nur ihr proximaler
Teil angefärbt. Fig. 5F zeigt einen männlichen AL im Stadium
P11. Hier ist die Entwicklung der Glomeruli nahezu abgeschlossen.
|
In den meisten Schnitten sind in der lateralen Zellgruppe gefärbte
Somata zu sehen. In der medialen Zellgruppe wurden durch die allatostatinähnliche
Färbung jedoch keine Zellen markiert. Eine Zählung der markierten
Zellen in verschiedenen Puppenstadien ergab, daß die Zahl der allatostatinähnlich
gefärbten Zellen zwischen des Stadien P7 und P8 sprunghaft ansteigt
(siehe Diagramm 1).
|
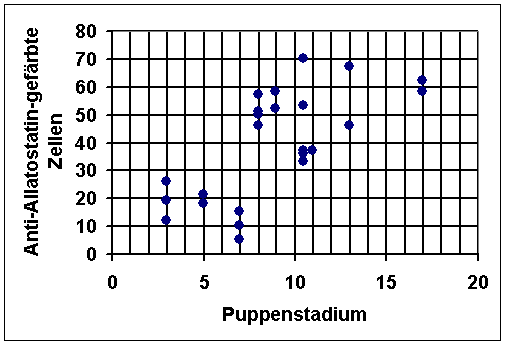
Diagramm 1
|
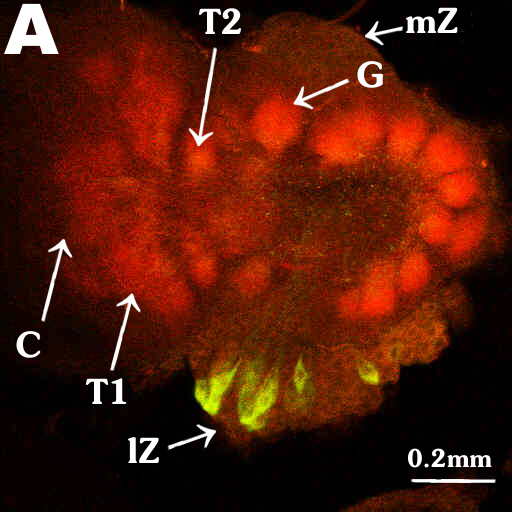
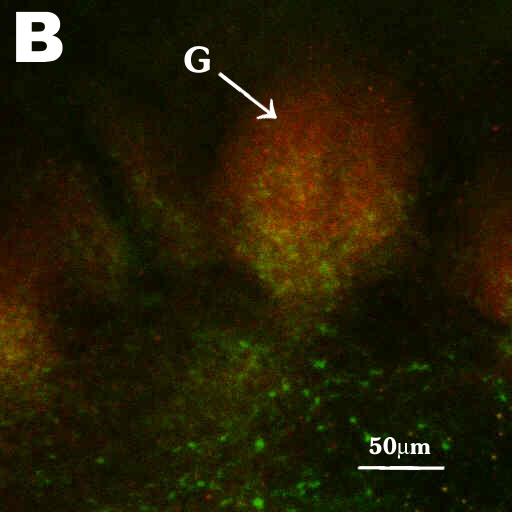
Fig. 6A und Fig. 6B zeigen die Aufnahmen der Flureszenz-Doppelfärbung
mit dem Konfokalen Laserscanmikroskop. Die grüne Farbe zeigt die allatostatinähnliche
Färbung und die rote die synaptotagminähnliche Färbung (gelbe
und orange Farbtöne kommen durch Überlagerung zustande). Fig.
6A zeigt einen männlichen AL. Man kann alle drei Teile des MGC unterscheiden:
Cummulus (C), Toroid1 (T1) und Toroid2 (T2). Fig. 6B zeigt eine Vergrößerung
des in Fig.6A gekennzeichneten Glomerulus. Hier sieht man deutlich, daß
die allatostatinähnliche Färbung nur den proximalen Bereich des
Glomerulus markiert (siehe auch Fig. 5E), während der ganze Glomerulus
synaptotagminähnliche Immunreaktivität zeigt.
 |
 |
| Fig. 6A |
Fig. 6B. |
IV. Diskussion
Die Ergebnisse zeigen, daß die Herausbildung der Glomeruli
zeitlich mit dem Anstieg des Hydroxyecdysontiters zusammenfällt. Die
allatostatinähnliche Färbung wirkt nur auf Zellen der lateralen
Zellgruppe (lZ) und dort auch nicht auf alle. Allatostatin ist ein Neuropeptid,
welches die Synthese von Junvenil-Hormon in der Corpora Allata hemmt. Die
laterale Zellgruppe enthält also Zellen, die ein allatostatinähnliches
Peptid enthalten, das vielleicht als Transmitter fungiert. Die Zahl dieser
Zellen steigt zwischen den Stadien P7 und P8 sprunghaft an. Andere Zellen
der lateralen Zellgruppe sowie alle Zellen der medialen Zellgruppe (mZ)
enthalten dieses Peptid offenbar nicht. Welcher funktionelle Unterschied
dieser Beobachtung entspricht, ist noch nicht bekannt. Ein ähnlicher
Unterschied zwischen lateraler und medialer Zellgruppe zeigt sich in der
FMRM-amid-Immunreaktivität (Homberg in [4]). Auch hier lassen sich
nur Zellen der lateralen Zellgruppe färben.
Bildnachweis:
Fig. 1:aus: http://zebra.biol.sc.edu/moth/manduca2.gif
Fig.2: aus [2]
Fig. 3: aus [5]
Fig. 4 von Dr. Joachim Schachtner
Literatur:
[1] "Fortbildungskurs der Deutschen Zoologischen Gesellschaft an der
Universität Konstanz 30.3.-7.4.1992;
Licht- und elektronenmikroskopische Methoden der Immuncytochemie; Kursteil
Lichtmikroskopische Immuncytochemie" Dr. U. Homberg, Konstanz
[2] "Postembryonic developmentt of the olfacttory system in the moth
Manduca sexta: primary-afferent control of glomerular development" von
John G. Hildebrand, Wolfgang Rössler und Leslie P. Tolbert erschienen
in "seminars in CELL & DEVELOPMENTAL BIOLOGY, Vol 8, 1997: pp163-170
[3] "Theory of Fluors and their use" http://gonzo.sci.man.ac.uk/Confocal/refer/fluor.html
[4] "Distributio of Neurotransmitters in the Insect Brain" von Uwe Homberg
[5] "Synaptic Organization and Development of the Antennal Lobe in Insects"
J. Boeckh and L.P. Tolbert erschienen in MICROSCOPY RESEARCH AND TECHNIQUE
24:260-280 (1993)
Erstellt am 15.03.1999
Letzte Änderung 20.08.1999 von Frank












